TOP > レポート&コラム > 宇宙科学の最前線 > 無容器プロセシング 過冷液体からの準安定相創製
![]()
| │1│2│3│ |
準安定相とは
準安定相とは熱平衡状態では存在しない相のことであり、熱力学的には不安定ではあるが、何らかの条件が満たされれば暫定的に存在し得る相のことをいいます。準安定相の研究は、19世紀末に告げられた「過飽和液体から最初に生成される相は必ずしも熱力学的に安定な相ではなく、液体とエネルギーの近い相である」という、いわゆるオストワルトのご託宣に端を発します。このご託宣はStep ruleと呼ばれ、その後さまざまな議論がなされましたが、筆者は「過飽和液体が凝固する際の核生成では融解のエントロピーΔSfの小さな相が優先される」と翻訳しました。
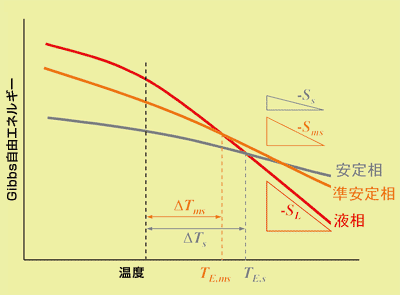
図1はStep ruleを考える上での熱力学的な関係の模式図で、液相と固相(安定相と準安定相)の温度−自由エネルギーを記してあります。液相が固相に変わるのは、液相の自由エネルギーが固相の自由エネルギーより大きくなるからで、両相のエネルギーが等しい点が融点になります。固相の自由エネルギーを準安定相と安定相で比べた場合、準安定相の自由エネルギーGmsは安定相の自由エネルギーGsよりも大きく、そのため、準安定相の融点(TE,ms)は安定相の融点(TE,s)より低くなります(下付き文字のsとmsはそれぞれ安定相、準安定相を意味します)。一方、図1において各曲線の傾き(Gibbsの自由エネルギーの温度係数)の絶対値は、圧力一定のもとでのエントロピーに対応します。図より、液相、安定相、準安定相のエントロピーSL、Ss、Smsの間にはSL>Sms>Ssの関係があり、したがって融解に伴うエントロピー変化ΔSfについては、ΔSf,s>ΔSf,msの関係(液相が準安定相に変化する方がエントロピー変化は少ない)が成り立ちます。また、上述の液相、安定相、準安定相の相対的な関係から、準安定相は安定相よりも高エントロピーの相となることが分かります。
|
物質のエントロピーを決めるものとしては、まずその物質の密度、次にその物質を構成している原子や分子の配列の対称性が挙げられます。したがって、固体よりは液体、液体よりは気体の方が高エントロピー相であり、固体同士なら低密度相の方が高エントロピー相となると考えられます。すなわち準安定相は、安定相よりも低密度で高対称性の物質といえます。
| │1│2│3│ |
