TOP > レポート&コラム > 宇宙科学の最前線 > 燃料電池を使ってCO2を除去する
![]()
| │1│2│3│ |
CO2を用いて電気をつくる
以上で述べてきたように、CO2還元は経験的に実現が困難であるものの、理論上は容易に生ずるはずです。私たちは、CO2還元を、発電装置である燃料電池に託すことにしました。
ここで、燃料電池について少し説明します。通常の燃料電池は、水素を負極に、また酸素を正極に供給することで発電する装置です。通常の蓄電池(乾電池)が酸化剤と還元剤をパッケージに封入しているのに対して、燃料電池は酸化剤(酸素)と還元剤(水素)を外部から供給する仕組みになっています。このことから、燃料電池は水素と酸素を供給する間は発電し続ける「発電装置」といえます。
燃料電池の代表ともいえる水素─酸素燃料電池の全反応は、(3)式で表されます。
H2+1/2O2=H2O+286kJ……(3)
この負極反応は、
H2→2H++2e−……(3.1)
また正極反応は、
1/2O2+2H++2e−→H2O……(3.2)
で表されます。この燃料電池においては、理論上(3)式の燃焼熱の83%(25℃)が電気エネルギーに高効率変換できるため、地上では家庭用途と自動車用途に実用化されています。
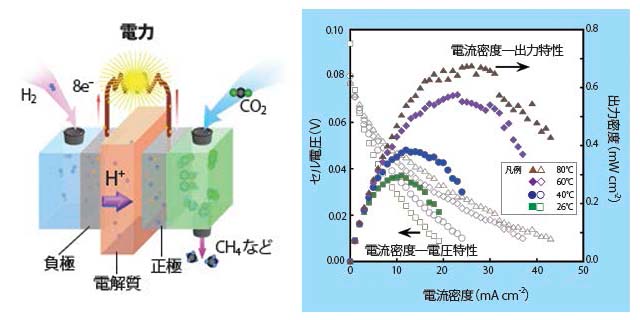
再度、(2)式に着目してください。私たちは、これに基づいて水素─二酸化炭素燃料電池を作製しました。燃料電池の構造を図1に示しますが、主要部分は極めて薄くコンパクトです。この構成は、固体高分子形燃料電池(PEFC)に分類されます。
図2左は、水素─二酸化炭素燃料電池の概念図です。負極には水素を供給し、その反応は
4H2→8H++8e−……(2.1)
また正極にCO2を供給した際の主要反応は
CO2+8H++8e−→CH4+2H2O……(2.2)
と考えられています。

|
|
水素─二酸化炭素燃料電池の発電試験結果を、図2のグラフに示します。グラフの横軸は正極─負極間の電流密度を示し、左縦軸は両極間の電圧、右縦軸は燃料電池出力を表しています。グラフより明らかなように、燃料電池が発電しています。また、発電出力の温度依存が分かります。
私たちの研究において、水素─二酸化炭素燃料電池が発電できることが初めて見いだされました。これは、実験に用いた電極材料が電極触媒として正常に作動した結果と考えています。ただし、問題もあります。生成物がCH4以外にも複数種類あること、生成物が電極に強く吸着して効率よく取り出すことが難しいこと、などです。現在、これらの解決に焦点を当てた研究を行っています。
| │1│2│3│ |
