| - Home page |
| - No.282 目次 |
| + 宇宙科学最前線 |
| - お知らせ |
| - ISAS事情 |
| - 科学衛星秘話 |
| - 内惑星探訪 |
| - 東奔西走 |
| - いも焼酎 |
| - 宇宙・夢・人 |
| - 編集後記 |
| - BackNumber |
地球生物重力適応システム
〜場の形成と張力維持に必須な細胞骨格とその分子シャペロン〜
東京大学大学院総合文化研究科
宇宙科学研究本部客員教授 跡 見 順 子
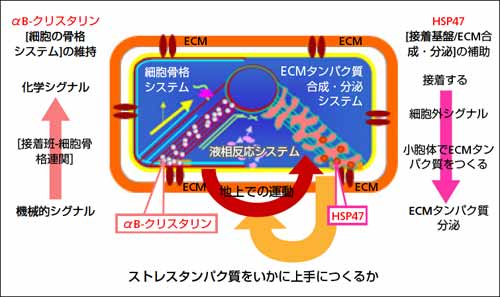
宇宙科学研究のうち生命科学分野においては,その重要なテーマに地球自身が生み出した生命システムの構築原理と,38億年にわたる進化・適応機構がある。ストレスに抗してシステム維持を追求する生命の戦略は,ストレスに対処する方法や科学技術を編み出した人間自身の存在の在り方にも示唆を与えてくれるはずである。中でもシステム原理として構成されていると考えられる“かたち”のある生物  特に人間を含む哺乳動物
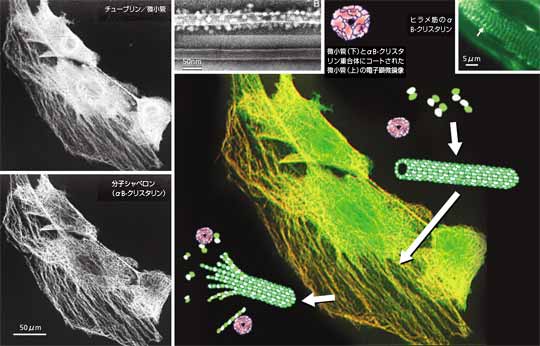
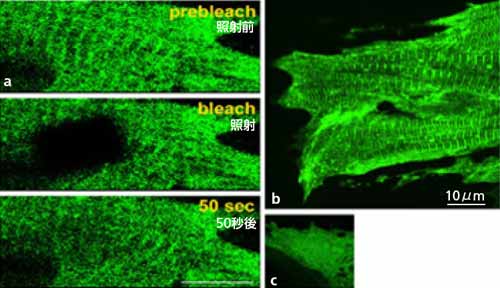
特に人間を含む哺乳動物  の重力適応の鍵分子として機能解析してきた構造対応システム・細胞骨格タンパク質,およびその時間適応に必須な分子シャペロン(タンパク質のお世話役のタンパク質)について紹介したい。からだがもっているストレス応答システムをうまく引き出すことで,適応が獲得されることが分かる。適応を生むストレス因子の中核は,重力・機械的刺激である。
の重力適応の鍵分子として機能解析してきた構造対応システム・細胞骨格タンパク質,およびその時間適応に必須な分子シャペロン(タンパク質のお世話役のタンパク質)について紹介したい。からだがもっているストレス応答システムをうまく引き出すことで,適応が獲得されることが分かる。適応を生むストレス因子の中核は,重力・機械的刺激である。
生物のかたちをつくる機械的・力学的システム
“地上”で家を建てる場合に基礎と柱が必要なように,かたちのある細胞も,かたちをつくるための力学的基盤としてタンパク質から成る細胞外マトリクスを,そして,かたちをつくる素材として細胞骨格をもつ。細胞骨格が発揮する強度(張力)は細胞により異なるが,細胞骨格を壊したり,細胞骨格のダイナミクスを止める物質を加えると細胞は死ぬ。また,基盤である細胞外マトリクスからはがしても細胞死が起こる。生態情報はゲノムに書き込まれているが,ゲノムがかたちをつくるわけではない。ゲノムを読み出す場は機械的に強度を必要とし,生物はそのために,細胞内外にタンパク質や糖などで,力学的に釣り合った強度に耐える構造をつくる。
 |
|---|
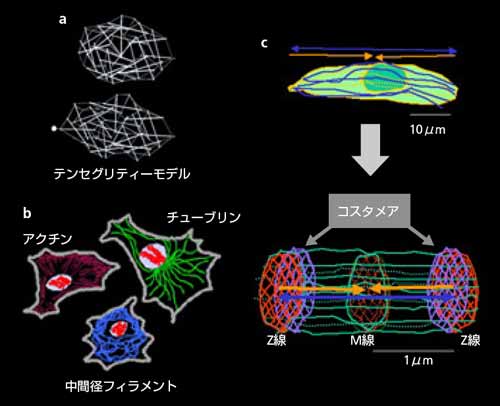
| 図1 細胞の骨格構造 a:テンセグリティーモデル(Ingber, 1997) b:3つの細胞骨格 c:筋芽細胞から筋線維への細胞骨格のリモデリング (サルコメアをつくる細胞骨格構造) |